摘要
肥胖是全世界的主要公共健康問題,並且它與發展為2型糖尿病的風險增加有關。現在普遍接受的是,與肥胖相關的慢性炎症在糖尿病患者中誘導胰島素阻抗和β細胞功能障礙。肥胖相關炎症的特徵在於巨噬細胞的豐度增加和脂肪組織中發炎細胞因子的產生增加。脂肪組織巨噬細胞被認為是局部和全身炎症介質,如腫瘤壞死因子α,白細胞介素(IL)-1β和IL-6的主要來源。這些細胞因子通過激活細胞因子信號蛋白抑制劑,幾種激酶如c-Jun
N末端激酶,IκB激酶β和蛋白激酶C,誘導型一氧化氮合酶,細胞外信號調節激酶等,誘導胰島素靶組織中的胰島素阻抗,以及蛋白酪氨酸磷酸酶,例如蛋白酪氨酸磷酸酶1B。這些激活因子削弱胰島素受體,和胰島素受體受質水平的胰島素信號傳導。相同的過程最可能發生在胰腺中,因為其含有組織駐留巨噬細胞池。通過趨化因子產生的高濃度的葡萄糖或棕櫚酸鹽,促進進一步的免疫細胞遷移和滲入胰島。這些事件最終誘導炎症反應,導致胰腺β細胞的凋亡。在這次審查,討論了參與肥胖誘導炎症調節的細胞和分子參與者,特別注意分子作用者的作用,連接發炎與胰島素阻抗和β細胞功能障礙。
一、前言
世界範圍內2型糖尿病(T2D)的迅速增加的流行率,是21世紀最嚴重和最具挑戰性的健康問題之一。世界衛生組織指出,2008年全球有3.34億人患有T2D,估計到2030年這一數字將翻一番。佔所有糖尿病病例的90%的T2D的特徵是胰島素阻抗和細胞功能障礙。胰島素阻抗是由外周靶組織(骨骼肌,肝和脂肪)不能有效響應正常循環胰島素濃度而引起的病理狀態。β細胞功能障礙是當β細胞不能產生足夠的胰島素時的病症。T2D正在達到流行階段,肥胖人群的流行率增加。3 T2D的發展是由於患者的遺傳背景與社會和環境因素的相互作用4所導致(圖。1)。神經和內分泌系統,久坐的生活方式,心理壓力,高脂肪飲食(HFD),暴飲暴食,年齡,吸煙,酒精攝入和睡眠不足的疾病是導致肥胖的一些原因。
已經建議炎症途徑作為肥胖症誘導的T2D的基礎介質。肥胖症與慢性低度炎症的狀態相關。這種低度炎症的特徵在於較高水平的循環促炎細胞因子和游離脂肪酸(FFA)。這些因素然後可以干擾正常的胰島素功能和分泌,從而誘導胰島素阻抗和β細胞功能障礙。在這次審查,最近的證據連接低度慢性炎症與T2D總結。首先,討論導致肥胖中的低度炎症的細胞和分子機制。第二,探討炎症在胰島素阻抗和β細胞功能障礙中的作用。
二、肥胖
在過去幾十年中,世界範圍內肥胖的流行率以驚人的速度增加。因此,肥胖症和相關疾病現在對公共衛生構成嚴重威脅。根據2013年“全球疾病負擔研究”的新分析,在過去33年中,成人(增加28%)和兒童(增加47%)的肥胖和超重率有驚人的增長,超重和肥胖人數從1980年的8.57億增加到2013年的21億。
三、發炎
2004年2月,“時代”雜誌專門報導炎症,並將其命名為“秘密殺手”。在過去十年中,變得清楚的是,炎症在肥胖症和T2D的發病機理中具有中心作用。在關注炎症在胰島素阻抗和β細胞功能障礙中的作用之前,將有助於介紹這個術語和可能不同於已經使用的經典背景的一些關鍵概念。
在經典文獻中,炎症是被調用以應對表現為腫脹,發紅,疼痛和發熱的損傷的組織的免疫應答。這是一個短期過程,其有助於組織修復,並涉及許多複雜的信號在不同的細胞和器官的集成。然而,長期炎症的長期後果具有不利影響,現在很好理解其調節異常在許多疾病如T2D,類風濕性關節炎,動脈粥樣硬化,哮喘和其它自身免疫疾病的發病機理中具有主要作用。這種病症主要由過量營養物引發,並且涉及類似的一組分子和信號傳導途徑至參與經典炎症的那些。
圖 1、遺傳背景,行為因素和環境觸發對T2D發展的影響。遺傳易感性,行為(例如,久坐的生活方式,高脂肪飲食)和環境因素(例如,心理應激)對T2D的發展具有互補作用。T2D,2型糖尿病。
四、肥胖誘導的T2D炎症疾病?
Hotamisligil等人通過報導來自4種囓齒動物肥胖和T2D模型的脂肪組織中的腫瘤壞死因子(TNF)-α(一種促炎細胞因子)的誘導,使肥胖症,炎症和T2D之間早期聯繫。他們證明在肥胖的fa / fa大鼠中TNF-α的中和改善了胰島素阻抗。此外,缺乏TNF-α的小鼠在飲食誘導和肥胖的ob / ob模型中,顯著改善胰島素敏感性。從這一發現的時間開始,許多研究已經顯示炎症信號破壞胰島素作用,並介導胰島素阻抗的肥胖。類似於囓齒動物的情況,在肥胖個體中,過量脂肪量與血液中促炎標記物C-反應蛋白水平的增加相關。增加的C-反應蛋白,其誘導型白細胞介素6(IL-6)並且IL-1b預測各種人群中T2D的發展。在鼠類模型和人類中,顯然肥胖引發免疫細胞,特別是巨噬細胞在內臟脂肪,肝臟,骨骼肌和胰腺組織中的積累,導致局部和全身炎症,最終導致全身胰島素阻抗和β-細胞功能障礙。
五、脂肪組織作為T2D中的炎症來源
肥胖和炎症之間的聯繫似乎是脂肪組織本身。脂肪組織不僅被認為是脂質儲存器官,而且是產生炎症反應和介質的關鍵部位。最近的研究已經證明,在脂肪組織和免疫系統之間確實存在幾個連接。一開始,通常可在脂肪組織中發現多種免疫細胞(包括T細胞,巨噬細胞和樹突狀細胞)。此外,已經提出白色脂肪細胞與免疫細胞共享胚胎起源,並且表徵的脂肪組織駐留淋巴細胞,導致這種組織是祖先免疫器官的概念。此外,未成熟造血細胞在脂肪組織中的存在提出這種組織可能是免疫細胞前體的形成和成熟的位點。
另一方面,脂肪組織可影響並與肝臟,肌肉,胰腺和其他器官連通,通過釋放細胞因子,脂肪因子和FFA。組織特異性敲除小鼠已經提供了許多獨特的見解,參與這些過程的信號通路的重要性。改善脂肪細胞胰島素敏感性的脂肪細胞的遺傳修飾,導致全身胰島素敏感性,在肝臟和骨骼肌細胞中具有增強的胰島素作用。因此,脂肪組織通常被稱為主要調節器,在全身胰島素阻抗的發展和潛在的窗口,通過它我們可以探索肥胖和炎症反應之間的聯繫。
脂肪組織被分類在2個主要倉庫:白色脂肪組織(WAT)和棕色脂肪組織。棕色脂肪組織涉及冷和減少生理熱生成(非繁殖生熱),體溫調節和能量消耗。 15 WAT專門存儲三醯甘油形式的能量儲存,保護其他器官和組織免受異位脂肪積累,從而降低脂肪毒性。直到20世紀90年代,WAT功能只與被動能量儲存,保溫,器官保護免受機械損傷,而現在被認為是一種動態和異質的內分泌器官。它由結締組織,細胞外基質和不同的細胞類型,如前脂肪細胞,脂肪細胞,脂肪組織巨噬細胞(ATMs),成纖維細胞,內皮細胞和幹細胞所組成。脂肪組織分泌眾多生物活性肽,統稱為脂肪因子(adipokines)。這些脂肪因子包括參與葡萄醣體內平衡的肽,如脂聯素(adiponectin),抵抗素(resistin),apelin和visfatin,以及參與能量穩態的激素如瘦蛋白(leptin)。脂肪組織還產生趨化因子如單核細胞趨化蛋白1(MCP-1)和IL-8,促炎細胞因子如IL-6,IL-1,血管緊張素II和TNF-α,以及抗炎細胞因子如IL- 10。因此,現在眾所周知,作為內分泌系統的脂肪組織在調節能量平衡,葡萄糖內穩態和免疫系統功能中起關鍵作用。
脂肪組織的過度生長導致脂肪細胞肥大和脂肪因子分泌譜的紊亂。這主要是由於促炎和抗炎脂肪因子的分泌之間的不平衡。脂肪細胞以及前脂肪細胞,巨噬細胞和脂肪幹細胞,有助於在肥胖中產生促炎細胞因子。在肥胖中的炎症反應中發揮關鍵作用的主要免疫細胞群在圖2中示出。
圖 2、肥胖中脂肪組織中免疫細胞群體的變化。瘦脂肪組織含有較大比例的M2 / M1巨噬細胞。它還含有大量調節性T細胞(Treg細胞)。肥胖症和脂肪細胞肥大導致脂肪細胞壞死和促炎症M1巨噬細胞數量的增加。在肥胖受試者的脂肪組織中,Treg細胞也減少,B細胞,CD4+ T輔助細胞(Th1)和CD8+ T細胞增加。
Fig. The role of adipokines in β-cell failure
六、巨噬細胞在不安全的炎症中扮演中心角色
一個重要的發現揭示了,組織炎症的原因是脂肪組織被大量巨噬細胞浸潤。這些ATMs(脂肪組織巨噬細胞)在肥胖脂肪組織中形成大約40%的細胞。廣泛的研究已經表明ATMs(脂肪組織巨噬細胞)在系統性胰島素阻抗,葡萄糖耐量和T2D中具有關鍵作用。在肥胖症中,ATMs中的炎症途徑被高度活化,這種活化導致多種細胞因子例如TNF-α和IL-1β的分泌。然後這些細胞因子可以通過旁分泌方式起作用,或者它們可以洩漏到全身循環中,導致胰島素靶細胞(脂肪細胞,肝細胞和肌細胞)中的胰島素敏感性降低和胰腺中的β細胞功能障礙。
巨噬細胞異質性。巨噬細胞已被分為2組:經典激活的巨噬細胞,稱為M1,以及替代激活的巨噬細胞,稱為M2。M1可以通過用粒細胞 - 巨噬細胞集落刺激因子生長骨髓來源的造血細胞在體外誘導。M2可以通過用巨噬細胞集落刺激因子和IL-4培養骨髓來源的細胞誘導。M1巨噬細胞的細胞因子譜是促炎的,包括TNF-α,IL-6和IL-1。相反,M2巨噬細胞表達抗炎因子,例如IL-10,轉化生長因子b,IL-1受體拮抗劑(IL-1RA)-α,IL-4和精氨酸酶。M1巨噬細胞被干擾素γ(IFN-γ)和脂多醣(LPS)刺激,而M2巨噬細胞被IL-4和IL-13激活。
肥胖通過在ATM群體中誘導M2轉移至M1,減少抗炎性IL-10產生並增加促炎症TNF-α產生。M1 ATM的這種增加是因為從M2到M1的“表型轉換”或從血管額外募集M1巨噬細胞。巨噬細胞的脂毒性似乎是M2對M1的這種表型轉換的主要貢獻者。M2到M1開關的詳細機制先前已由Olefsky和Glass綜述。簡言之,toll樣受體4(TLR4)配體例如飽和FFA激活核因子κB(NF-kB)和激活蛋白1(AP1)轉錄因子,並且這些活化導致促炎細胞因子例如TNF-α,IL-6和IL-1的產生增加,產生M1表型。在瘦的脂肪組織中,通過核受體抑制子復合物抑制TLR4反應性基因來防止該過程。過氧化物酶體增殖物激活的受體g以及IL-4和IL-13阻止了核受體抑制子的信號依賴性周轉,從而有助於維持M2表型。
招聘巨噬細胞進入脂肪組織。巨噬細胞募集到脂肪組織中是肥胖症誘導的炎症中的最初事件。肥厚的脂肪細胞分泌趨化因子例如MCP-1,白三烯B4(LTB4)等,提供趨化性梯度,其將單核細胞吸引到脂肪組織中。一旦單核細胞遷移到脂肪組織中,它們可以分化成ATM。在遷移到脂肪組織中後,促炎ATM也分泌其自身的趨化因子,吸引額外的巨噬細胞並建立前饋炎症過程。
通過擴大脂肪細胞分泌的MCP-1,似乎是肥胖症中脂肪組織炎症引發的關鍵介質。已經顯示MCP-1在將巨噬細胞募集到脂肪組織中起重要作用。MCP-1結合巨噬細胞上的趨化因子(CC基序)受體2(CCR2)以刺激巨噬細胞遷移。Weisberg等人報導,巨噬細胞CCR2或脂肪組織MCP-1的缺失降低ATM含量,減少炎症的組織標記物,並改善胰島素阻抗。然而,相反的發現已經從其他研究報告。根據Chen等人的研究,單獨的CCR2和MCP-1不顯著影響巨噬細胞募集,並且這個問題仍有待完全解決。
幾種其它趨化因子也參與炎症細胞的募集。LTB4是中性粒細胞上的有效趨化因子,由脂肪細胞產生,其中它可以有助於ATM滲透。實際上,在最近的研究中已經證明,敲除編碼LTB4受體(BLT1)的基因,可以保護小鼠免於肥胖誘導的炎症和胰島素阻抗。Fractalkine也稱為趨化因子(C-X3-C基序)配體1 CX3CL1)在脂肪細胞和巨噬細胞中表達,並且在肥胖人脂肪組織中顯著上調,並且有助於單核細胞與脂肪細胞的粘附。儘管CX3CL1-CX3CR1(fractalkine受體)系統在慢性炎症疾病如動脈粥樣硬化中起重要作用,但其在脂肪組織炎症中的作用尚不清楚。
在脂肪組織中巨噬細胞募集中起重要作用的另一種化學引誘因子,是從肥大脂肪組織中滲出的飽和FFA。在一項研究中,Takahashi等人顯示,通過經由c-Jun N末端激酶(JNK)和NF-κB活化誘導MCP-1產生,補充棕櫚酸鹽引起單核細胞募集到肥大的鼠脂肪細胞中。
淋巴細胞(Lymphocytes)。除了巨噬細胞,淋巴細胞似乎強烈牽連與肥胖相關的炎症過程。認為脂肪組織中的T細胞通過修飾ATM數量及其活化狀態,而在肥胖症誘導的炎症中起作用。根據表面蛋白,T細胞可分為2個主要類別。細胞毒性CD8+細胞表達糖蛋白CD8+,CD4+細胞在其表面表達CD4+。CD4+ T細胞可進一步分為2個譜系:產生促炎細胞因子的T輔助1(Th1)細胞和產生抗炎細胞因子的T輔助2(Th2)細胞。另一種CD41譜系,調節性T細胞(Treg細胞),可以分泌抗炎信號,抑制巨噬細胞遷移,並誘導M2樣巨噬細胞分化。脂肪組織Treg細胞的數量隨肥胖減少,並且肥胖小鼠中這些細胞的數量的增加可以改善胰島素敏感性。已經顯示,CD4+T淋巴細胞對全身胰島素阻抗具有保護作用,因為缺乏T淋巴細胞的重組激活基因1缺陷小鼠,在餵食HFD時發展了顯著程度的胰島素阻抗。CD8+T稱為效應細胞或細胞毒性T細胞,也分泌促炎細胞因子。 Nishimura等人顯示,在肥胖脂肪組織中CD8+T細胞增加,並且它們促進ATM的募集和激活,同時減少CD4+輔助細胞和Treg細胞。
在肥胖症發展期間,不同T細胞和巨噬細胞在脂肪組織中積累的時間模式仍然沒有被完全理解。Nishimura等人提出,脂肪組織Th1細胞可能在ATM滲入之前引發炎症級聯反應。然而,Strissel等人最近發現,在引入HFD後20週,在ATM和胰島素阻抗增加幾個月後,Th1細胞數目沒有增加。無論炎症細胞募集的時間過程如何,儘管T細胞在體內顯然對炎症和胰島素阻抗的發展具有作用,但它們對於該過程不是絕對必要的,因為耗盡淋巴細胞的肥胖小鼠仍然可以引起ATM介導的炎症反應並且發展降低的胰島素敏感性。
除了T細胞,B細胞也可以在HFD餵養的肥胖小鼠的脂肪組織中累積。實際上,最近的一項研究表明,B細胞的募集可以促進T細胞的活化並增強M1樣巨噬細胞的極化。此外,B細胞可以通過產生致病性免疫球蛋白G(IgG)自身抗體引起全身效應。
肥大細胞(Mast cells)。在1963年提出在肥胖高血糖小鼠的脂肪組織中肥大細胞數量增加。這一發現最近在肥胖小鼠和人中由Liu等人證實。肥大細胞分泌廣泛的介質,如IL-6和IFN-γ,可以調節發炎的WAT的環境。肥大細胞衍生的IFN-γ,基質金屬蛋白酶9(matrix metalloproteinase 9)和磷脂酶A2(phospholipase A2)是調節巨噬細胞活化的介質之一。
嗜酸粒細胞(Eosinophils)。脂肪組織嗜酸性粒細胞可能在維持M2樣ATM極化狀態中起作用,嗜酸性粒細胞的脂肪組織含量在肥胖中大大降低。WAT中的常駐嗜酸性粒細胞被鑑定為IL-4和IL-13,並且在它們不存在的情況下,M2類ATM的數量大大減少。嗜酸性粒細胞缺陷型小鼠比HFD上的野生型小鼠顯示更多的炎症和胰島素阻抗。此外,嗜酸性嗜酸性小鼠顯示改善的HFD餵養的肥胖小鼠的葡萄糖耐量,表明嗜酸性粒細胞有助於控制脂肪組織炎症和促進正常胰島素敏感性通過促進M2樣ATM極化狀態。沿著這些路線,肥胖症中減少的脂肪組織嗜酸性粒細胞可以有助於炎症和胰島素阻抗。
自然殺手細胞(Natural killer cells)。自然殺手(NK)細胞存在於許多代謝組織,例如肝和脂肪組織中。NK細胞在肥胖和WAT炎症中的作用不完全清楚。雖然幾個小組報導了循環NK細胞在肥胖症中的數目不變,其他觀察到顯著較低數量的循環NK細胞在肥胖受試者。NK細胞和其他白細胞,(包括淋巴細胞,巨噬細胞和嗜中性粒細胞之間的強烈串擾存在,因為B和T細胞缺陷小鼠具有協調增加的NK細胞和ATM。在肥胖的人中,有證據表明脂肪組織NK細胞是炎症細胞因子如IFN-γ或TNF-α和幾種趨化因子的來源,包括MCP-1和趨化因子(CX-C基序)配體8(CXCL8)。
中性粒細胞(Neutrophils)。中性粒細胞處於免疫應答的第一防線,滲入炎症組織。它們通過產生MCP-1和其它趨化因子促進炎性單核細胞的隨後募集。中性粒細胞與先天免疫和適應性免疫的多種組分進行通信,並且與巨噬細胞免疫功能密切相關。嗜中性粒細胞在肥胖症誘導的炎症中的作用尚不清楚,但中性粒細胞和肥胖之間存在明顯的關聯。肥胖成人和兒童中觀察到循環中性粒細胞輕度增加。中性粒細胞在脂肪組織中少量存在,但即使用短期HFD進食也會遷移到脂肪中。
七、肥胖如何引起炎症?
已經提出了幾種機制來解釋,肥胖如何導致脂肪組織中的炎症。在下一節中,我們討論這些提出的假設。
脂肪因子調節炎症細胞因子的產生和釋放。脂肪細胞分泌大量不同性質的生物活性分子,統稱為脂肪因子,其中許多具有免疫調節作用。兩種主要脂肪因子是瘦素(leptin)和脂聯素(adiponectin)(圖3)。
圖 3、肥胖中炎症的背景下脂肪細胞和巨噬細胞之間的關係。肥大的脂肪細胞存在改變的脂肪因子,細胞因子和FFA的分泌。已經提出了包括脂肪因子分泌,ER應激,增加的FFA釋放,增加的ROS產生和缺氧的不同因素,作為脂肪細胞炎症的原因。脂肪細胞炎症導致局部和系統地釋放促炎細胞因子,這些炎症因子又可誘導T2D中的胰島素阻抗和β細胞功能障礙。ER,內質網; FFA,游離脂肪酸; IL,白介素; MCP,單核細胞趨化蛋白; ROS,活性氧; T2D,2型糖尿病; TNF,腫瘤壞死因子。
瘦蛋白(Leptin),第一個發現的脂肪因子,可以調節各種水平的免疫功能:上調吞噬功能,刺激體外人類循環單核細胞的增殖和分化成巨噬細胞,調節NK淋巴細胞的激活,並誘導促炎細胞因子(TNFα,IL-6和IL-12)。動物模型研究表明,瘦素的缺失導致免疫功能缺陷。例如,瘦素缺乏(ob / ob)小鼠具有嚴重的胸腺萎縮,較低的淋巴細胞和NK細胞數,降低的細胞毒性活性和降低的促炎細胞因子的表達。這些小鼠和db / db小鼠(攜帶缺陷型瘦蛋白受體基因的小鼠)在抵抗感染方面效率較低。瘦蛋白是體內能量儲存狀態的傳感器,當這些儲存物增大時,它作用於中樞神經系統,特別是下丘腦,以抑制食物攝取並刺激能量消耗。循環瘦素水平與身體脂肪量的增加同時增加。然而,眾所周知,在大多數情況下,人類肥胖伴隨著瘦素抗性和代償性高瘦素血症。 這種瘦素抗性狀態可能對免疫細胞的激活具有可能的後果。在這方面,瘦素受體表達的脂肪細胞特異性下調,模擬飲食誘導的肥胖的脂肪組織中瘦素抗性的狀態,導致增加在TNF-α表達。
脂聯素(Adiponectin)是具有抗炎和胰島素敏化特性的脂肪細胞激素,對瘦素具有相反的免疫調節作用。它抑制巨噬細胞中的吞噬活性和TNF-α的產生,單核細胞前體的分化,內皮粘附分子的合成和泡沫細胞的形成。此外,其刺激抗炎性IL的釋放,例如IL-10或IL-1RA。人類研究已經揭示,不同於瘦素,脂聯素濃度與體脂肪量呈負相關。總之,這兩種主要脂肪因子水平的變化,可能有助於全身性炎症的發生和維持,以及肥胖症中存在的胰島素阻抗。
脂肪酸可以誘導炎症。異常增加的血脂水平,包括非酯化的FFA是肥胖症中的共同特徵。脂肪組織作為一個整體具有有限的擴張和儲存能量的能力。超過這個限度導致脂肪細胞內脂肪分解增加和FFA隨後釋放到血流中。從血液中,FFA在整個身體的組織中積累,包括肝,肌肉和胰腺,其中它們干擾組織的正常代謝。
FFA的化學性質與引發炎症反應有關。對體重不一致雙胞胎的研究已經顯示,肥胖個體在脂肪組織中表現出胰島素阻抗和刺激的炎症反應的跡象,當與他們相比於瘦雙胞胎。這些改變平行於脂肪組織脂肪酸組成中的相當大的差異,這導致肥胖雙胞胎中硬脂酸,亞油酸和α-亞麻酸的比例減少,以及棕櫚油酸和花生四烯酸的水平增加。飽和脂肪酸似乎是特別重要的在這方面,因為它們可以刺激脂肪細胞中的TNF-α和IL-6產生。此外,似乎在來自脂肪細胞的飽和FFA和來自巨噬細胞的細胞因子之間存在正反饋迴路:飽和FFA可以增加巨噬細胞中TNF-α的產生,進而免疫細胞誘導脂肪細胞中的脂解。這些事件加速了肥胖症中脂肪組織的炎症變化
FFAs如何引發炎症反應?在這方面的潛在機制之一可以是FFA對脂肪細胞生成和分泌的影響。例如,脂聯素水平與飽和FFA和多不飽和脂肪酸分別呈負相關和正相關。或者,FFA可通過細胞受體的活化直接誘導炎症途徑。最近的證據表明飽和的FFA可以通過結合TLR,特別是TLR4起作用。這種結合導致NF-kB途徑的激活,導致脂肪細胞中炎症反應的誘導。反過來,促炎細胞因子刺激脂解並增加FFA水平,導致脂肪組織中的病況惡化。
太多的營養物導致細胞應激。過度的脂肪組織生長在細胞和亞細胞水平具有進一步的後果。粒線體和內質網(ER)是在肥胖中受影響的兩個脂肪細胞。簡而言之,ER是蛋白質合成和三醯基甘油小滴形成的主要位點。在細胞應激的條件下,ER功能逐漸受損,這觸發稱為“解折疊蛋白反應”(UPR)的安全機制。肥胖的營養過量和細胞擴張的狀態意味著對蛋白質和三醯基甘油小滴形成的更大需求,並且這也可以誘導ER應力和UPR。ER穩態的中斷由三種不同的分子組分,肌醇需要蛋白1(IRE1),激活轉錄因子6和雙鏈RNA依賴性蛋白激酶(PKR)樣ER激酶感知。他們一起調節許多基因的表達,以試圖緩解ER應激。UPR還與(1)活性氧(ROS)的產生,因此更大的氧化應激和(2)活化的炎症途徑,具有增加的細胞因子例如IL-8,IL-6,MCP-1和TNF-α的表達。
在肥厚的脂肪組織中,脂解作用增加,這導致細胞FFA的過量。這種情況與葡萄糖過量結合導致氧化途徑的活性增加。隨著時間的推移,這種能量過量導致粒線體功能障礙,其隨後導致ROS產生增加。這樣的氧化應激可以通過誘導氧化還原敏感性轉錄因子如NF-kB來激活免疫系統。
肥胖脂肪細胞需要氧。如前所述,當肥胖脂肪細胞接受更大的營養供應時,肥胖脂肪細胞變得越來越大。因此,肥胖中的脂肪組織擴張最終達到局部脈管系統的發展不足的程度,並且組織不能滿足遠距離擴大的脂肪細胞的氧需求。動物和培養模型中的研究表明,缺氧脂肪細胞產生炎症信號以刺激血管生成。缺氧細胞反應的啟動的關鍵因素是缺氧誘導因子1(hypoxia-inducible factor 1),一種在含氧量正常條件下高度不穩定的轉錄因子。低氧誘導因子1調節參與不同功能,包括血管生成,炎症和能量代謝的大量基因的表達。這些基因中的一些是瘦素,纖溶酶原激活物抑制劑1和巨噬細胞遷移抑制因子,它們都在肥胖中上調。
缺氧對脂肪細胞代謝具有重要的影響,因為它迫使細胞從有氧糖酵解轉換為無氧糖酵解以從葡萄糖獲得能量。這導致增加的乳酸鹽從脂肪細胞的產生和釋放。已經顯示乳酸鹽刺激巨噬細胞中的炎症途徑,並增強LPS誘導的前脂肪細胞的炎症反應。
脂肪細胞不是對脂肪組織內缺氧響應的唯一細胞。常駐巨噬細胞傾向於在缺氧區域周圍積累,可能通過從受影響的脂肪細胞釋放的趨化信號募集。它們通過產生促炎細胞因子以與脂肪細胞類似的方式對缺氧反應。顯然,缺氧反應不能達到增加脂肪組織血管形成的預期效果,而是導致局部纖維化的情況,這有助於脂肪組織功能障礙。71 與此相一致,已經發現缺氧誘導培養的脂肪細胞中的UPR。
八、炎症的介導
如前所述,慢性低度全身性和局部炎症可,以將肥胖症與胰島素阻抗聯繫起來。在本節中,我們討論炎症反應的調解員在脂肪組織及其免疫細胞區室中的作用。
Toll樣受體。TLR是模式識別受體(PRR)家族,它通過識別病原體相關分子模式(PAMP)在早期先天免疫中起關鍵作用。來自垂死宿主細胞的內源性成分,稱為損傷相關分子模式,也可以激活TLR。TLR是在不同的免疫和非免疫細胞,例如B細胞,樹突細胞,巨噬細胞,肥大細胞,NK細胞,上皮細胞,成纖維細胞和內皮細胞上表達的跨膜蛋白。根據其細胞定位,TLR大致分為2個亞組。TLR1,TLR2,TLR4,TLR5和TLR6位於細胞表面,並識別微生物膜組分,而TLR3,TLR7,TLR8和TLR9在細胞內囊泡內表達並識別核酸。每個TLR能夠感測不同的PAMP子集和激活不同的細胞反應。TLR2識別多種結構多樣的PAMP,如脂蛋白或脂肽。TLR1和TLR6與TLR2複合,分別區分三醯基肽和二醯基肽。TLR4識別主要細胞壁成分革蘭氏陰性菌的LPS。TLR活化觸發幾種細胞內信號傳導途徑,導致所有TLR共有的轉錄因子例如NF-kB和AP1的活化。這種激活導致炎症細胞因子和趨化因子的產生。一些TLR還可以激活干擾素調節因子,導致產生1型IFN如IFN-α家族和IFN-β以及趨化因子RANTES(在激活正常T細胞上調節表達和分泌)
在不同類型的TLR中,已報導TLR4在脂肪組織炎症中具有關鍵作用。肥胖小鼠和肥胖和糖尿病患者的脂肪組織中TLR4表達增加。來自革蘭氏陰性菌的飽和FFA和LPS是脂肪細胞和巨噬細胞中TLR4的潛在配體。缺乏TLR4的小鼠提供了關於TLR4在肥胖症誘導的炎症中的作用的更多證據。已經報導了來自缺乏TLR4的小鼠的不同組織,特別是脂肪組織的炎症的輕度減少。脂肪組織中減少的炎症是由於巨噬細胞浸潤的減少或巨噬細胞向M2抗炎表型的極化的變化。總之,這些發現提供了TLR4是肥胖症相關炎症的關鍵介質的證據。
核因子κB(Nuclear factor kappa B)。NF-kB在調節炎症中起關鍵作用。在基礎(靜止)狀態下,NF-kB通過其與B細胞抑制劑α(IkBα)中的κ輕鏈多肽基因增強子的結合保留在細胞質中。響應於細胞刺激,IkBa蛋白在2個保守的絲氨酸殘基上磷酸化,通過B細胞中κ輕鏈多肽基因增強子的抑制劑,激酶β(IKKβ)。該磷酸化誘導IkBα的蛋白酶體依賴性降解,導致NF-kB的核轉位。在細胞核中,NF-kB通過結合啟動子中的特定序列來反式激活炎症基因
NF-kB激活有兩個主要途徑:規範和非規範途徑。規範途徑由包括TLR和NOD樣受體(NLR)的PRR激活啟動。PRR檢測PAMP,包括微生物來源的LPS,肽聚醣和細菌DNA,以及損傷相關分子模式如飽和FFA。非典型途徑在刺激TNF受體家族成員例如CD40或淋巴毒素β受體後被激活。
人類和動物研究還支持NF-kB在肥胖症誘導的炎症中的作用。已經報導了肥胖動物的脂肪細胞中NF-kB的活性增加。此外,IKKb的藥理學抑制劑(例如阿司匹林)或通過IKKβ的遺傳缺失對NF-kB途徑的抑制,證明了肥胖誘導的動物炎症的改善。這些結果在糖尿病患者中得到證實,因為用阿司匹林治療患者改善血糖控制以及抑制其PBMC中的NF-kB活性。總之,這些發現表明NF-kB在肥胖症中的關鍵作用,誘導的炎症和該途徑的抑制,可能是治療胰島素阻抗和糖尿病的潛在目標。
C-Jun N-末端激酶(JNK)。JNK是來自涉及細胞應激反應、凋亡、增殖、分化、遷移和轉化的絲裂原活化蛋白激酶(MAPK)家族的更大組的絲氨酸 - 蘇氨酸(Ser-Thr)蛋白激酶的成員。兩個主要JNK,JNK1和JNK2的同種型已經被生物化學表徵。JNK通過響應於多種細胞信號(包括炎症細胞因子,生長因子和環境脅迫),在特異性蘇氨酸(Thr)和酪氨酸(Tyr)殘基處的雙重磷酸化而激活。磷酸化JNKs通過磷酸化幾個調節Ser / Thr位點激活轉錄因子c-Jun。活化的c-Jun與c-Fos同源二聚化和/或異源二聚化,產生AP1轉錄複合物,其與靶啟動子上的特異性DNA序列結合,並調節同源基因的表達。
JNK信號通路被肥胖激活。還提示JNK信號傳導有助於炎症。在這方面,Solinas等人使用過繼轉移來產生在抗輻射(非造血)或造血細胞中缺乏JNK1的小鼠。該研究的數據表明JNK1缺乏,通過至少2種機制保護對抗飲食性胰島素阻抗。在非造血區室中缺乏JNK1防止飲食誘導的肥胖,並通過維持較瘦的體重,導致間接改善胰島素敏感性。相反,JNK1在造血室中的缺失不影響肥胖,並且對胰島素受體信號傳導具有直接作用,但通過減少肥胖症誘導的炎症,仍然保護免受HFD介導的胰島素阻抗。在HFD餵養的小鼠的肝臟和脂肪組織中的促炎細胞因子在造血隔室中的JNK1缺失上減少。還已經顯示JNK1是FFA介導的巨噬細胞中促炎細胞因子產生誘導所需的。基因表達分析顯示,棕櫚酸鹽介導的IL-6和TNF-α信使RNA(mRNA)的誘導,在來自JNK12 / 2小鼠的腹膜巨噬細胞中顯著降低。在另一項研究中,Han等人提示,當JNK1缺失時,骨髓系細胞中的JNK2可能在肥胖誘導的胰島素阻抗的發展中發揮更大的作用。他們報導,餵養HFD對照和JNK缺陷小鼠引起類似的肥胖,但只有具有JNK缺陷巨噬細胞的小鼠保持胰島素敏感。在具有巨噬細胞特異性JNK缺陷的小鼠中,抗胰島素阻抗的保護與巨噬細胞的組織浸潤減少有關。免疫分型表明JNK是促炎性巨噬細胞極化所必需的。總之,這些研究表明巨噬細胞中的JNK是建立肥胖症誘導的炎症所需的。
ER應激(ER stress)。如前所述,ER是負責多肽合成和肽的轉譯後修飾和折疊,脂質和固醇的合成以及維持細胞內鈣穩態的細胞內細胞器。ER應激是在生物合成期間存在過量蛋白質錯誤折疊時發生的現象。雖然UPR是細胞恢復ER穩態的適應性反應,但嚴重或延長的ER應激與各種疾病,包括神經變性疾病,發育障礙,糖尿病,囊性纖維化,感染性代謝疾病,炎性疾病,癌症,細胞死亡和組織損傷。ER應激被認為誘導炎症,並且ER應力與局部和全身炎症之間存在直接聯繫。ER應激涉及與促炎細胞因子IL-1b的產生相關的許多炎性疾病。在Shenderov等人的一項研究中,經歷ER應激的巨噬細胞能夠在體外響應LPS刺激,而驅動前IL-1β的產生和加工。從應激細胞釋放的炎症細胞因子,可能作為警報或危險信號與其他細胞溝通或招募免疫細胞。IRE1α在炎症基因的轉錄中發揮關鍵作用,IRE1α和TNF受體相關因子2 (TRAF2)促進NF-kB和JNK通路。除了NF-kB通路外,IRE1α / TRAF2也可以激活AP1轉錄因子,促進炎症細胞因子的表達。
NOD樣受體(NOD-like receptors)。NLR包含大家族的細胞內PRR。它們是細胞內微生物和危險信號的關鍵傳感器,並且在感染和免疫中起重要作用。NLR家族的成員與兩種其他蛋白質(包含CARD(caspaserecruitment結構域)(ASC)和依賴於半胱氨酸依賴性天冬氨酸的蛋白酶1(胱天蛋白酶原1)的凋亡相關的斑點狀蛋白質組裝成大的多蛋白複合物,以形成稱為炎症體(inflammasomes)的大的多聚體蛋白複合物。炎症小體(inflammasomes)的主要功能是從胱天蛋白酶原1激活胱天蛋白酶1,這導致未成熟的前IL-1和前IL-18加工成成熟的IL-1和IL-18。炎症小體(Inflammasomes) 也調節pyroptosis,一種半胱天冬酶1-依賴形式的細胞死亡。在NLR家族中,包含3的NLR pyrin結構域(NLRP3),已經顯示在肥胖誘導的炎症中具有重要作用。在這方面,最近報導了NLRP3炎症小體相關基因的表達和胰島素阻抗之間的強相關性,來自患有葡萄糖耐量的肥胖男性受試者的腹部皮下脂肪組織。此外,與健康對照受試者相比,患有T2D的患者俱有增加的單核細胞來源的巨噬細胞中NLRP3,ASC,IL-1β和IL-18mRNA和蛋白質表達的水平。NLRP3炎性體與胰島素阻抗和肥胖之間的關聯已經由動物研究提示,顯示NLRP3的遺傳消融改善胰島素敏感性和葡萄糖內穩態。小鼠中NLRP3的消融也已報導保護免於脂肪組織中肥胖相關的巨噬細胞活化,減少M1樣巨噬細胞基因表達,並增加M2樣細胞因子的表達。這種效應與NLRP3缺陷型肥胖小鼠中M2巨噬細胞數目的增加相關,而不影響M1巨噬細胞頻率。此外,已建議細胞內神經醯胺,ER應激,ROS產生和鉀流出來激活NLRP3炎症小體,導致人巨噬細胞隨後釋放IL-1β。總的來說,這些數據表明NLRP3炎症小體在感應肥胖症相關的半胱天冬酶1激活的誘導物中具有重要作用,因此調節炎症的發展和程度。
九、連接肥胖的炎症介質胰島素阻抗
腫瘤壞死因子α(Tumor necrosis factor α)。TNF-α是許多細胞產生的有效免疫調節細胞因子,包括脂肪細胞,角質形成細胞,肥大細胞,朗格漢斯細胞,單核細胞和巨噬細胞。TNF-α涉及廣泛的人類疾病的發病機理,例如敗血症,糖尿病,癌症,骨質疏鬆症,多發性硬化,類風濕性關節炎和炎性腸病。TNF-α可以激活MAPK和NF-kB信號通路,導致其他炎性細胞因子,如IL-1β和IL-6的釋放。Kern等人顯示,與瘦控制相比,肥胖個體在其脂肪組織中具有2.5倍更多的TNF-α。Hotamisligil等人證實TNF-α通過抑制骨骼肌和脂肪組織中的胰島素受體酪氨酸激酶活性,參與肥胖相關的全身胰島素阻抗。Peraldi等還報導了人TNF-α抑制胰島素受體和胰島素受體受質1(IRS-1),在脂肪細胞和骨髓32D細胞中的胰島素依賴性酪氨酸磷酸化。此外,用TNF-α處理3T3-L1脂肪細胞導致葡萄糖轉運蛋白4(GLUT4)的蛋白水平降低,以及蛋白激酶B(Akt)的活性降低。這些數據一起證明TNF-α是肥胖中胰島素阻抗的關鍵介質,並且其中和(neutralizing)可以改善患有T2D的患者中肥胖誘導的胰島素阻抗。
白細胞介素1(Interleukin 1)。IL-1β是IL-1家族中研究最多的成員,因為其在介導自身炎症疾病中的作用。IL-1是通過由許多先天免疫細胞(包括巨噬細胞和樹突細胞)產生的IL-1I型受體(IL-1RI)發揮其生物活性的炎症的主要介質。IL-1β與IL-6的濃度預測了人類T2D的風險。Juge-Aubry等人報導了肥胖個體的WAT中IL-1β和IL-1RI表達顯著增加,並且這種增加的表達進一步有助於體重增加,因為它們分別對下丘腦和脂肪細胞具有內分泌和旁分泌作用。TNF-α和IL-1β協同增強WAT巨噬細胞和脂肪細胞中的炎症,在不存在IL-1RI時喪失的作用。還已經報導,IL-1β通過通過細胞外信號調節激酶(ERK) - 依賴性機制在轉錄水平和ERK非依賴性機制在轉錄後水平降低IRS-1表達。IL-1通過其I型受體也激活許多轉錄因子,包括參與炎症反應的NF-kB,AP1和環狀腺苷單磷酸響應元件結合蛋白。
白細胞介素6(Interleukin 6)。IL-6是最初鑑定為B細胞分化因子(BSF-2)的多功能細胞因子。IL-6由多種組織產生,包括脂肪細胞,活化的白細胞,內皮細胞,骨骼肌和肝臟。約25%的體內系統性IL-6由皮下脂肪細胞產生。IL-6是典型的促炎細胞因子,其是人類T2D發展的危險因素。WAT表達和IL-6的血漿水平與體重指數正相關,並且它通過促進IRS-1的絲氨酸磷酸化對胰島素信號傳導產生負面影響。儘管來自WAT和肝臟的IL-6分泌增加是不利的,但骨骼肌的情況則相反。身體不活動,其誘導胰島素阻抗,與減少的骨骼肌IL-6表達和分泌相關。此外,由運動引起的血漿IL-6水平的增加之後是IL-1RA和IL-10水平的增加。
十、如何慢性炎症導致胰島素阻抗?
胰島素信號。胰島素作用由胰島素與其受體的相互作用引發。胰島素受體由2個細胞外α亞基和2個細胞內β亞基組成。胰島素與亞基的結合激活β亞基中的酪氨酸激酶。在酪氨酸激酶激活胰島素受體時,β亞基的自磷酸化導致激酶活性的擴增。然後它招募IRS蛋白家族。磷酸化的IRS蛋白質作為具有src同源2(SH2)結構域的各種效應分子的對接蛋白。大多數胰島素的代謝和抗細胞凋亡作用,由涉及IRS的磷酸化和這些SH2的活化的信號傳導途徑介導結構域蛋白。這種激活導致多個下游效應子的激活,其最終將胰島素信號傳遞到調節細胞分化,生長,存活和代謝的分支系列的細胞內途徑。
十一、胰島素阻抗
臨床上,術語“胰島素阻抗”意味著需要大於正常濃度的胰島素來維持血糖正常。在文獻中,術語胰島素阻抗意味著對胰島素對葡萄糖攝取,代謝或儲存的影響的抗性。肥胖和T2D中的胰島素阻抗,通過減少胰島素刺激的葡萄糖轉運和脂肪細胞和骨骼肌中的代謝,以及通過受損的肝葡萄糖輸出的抑制來表現。
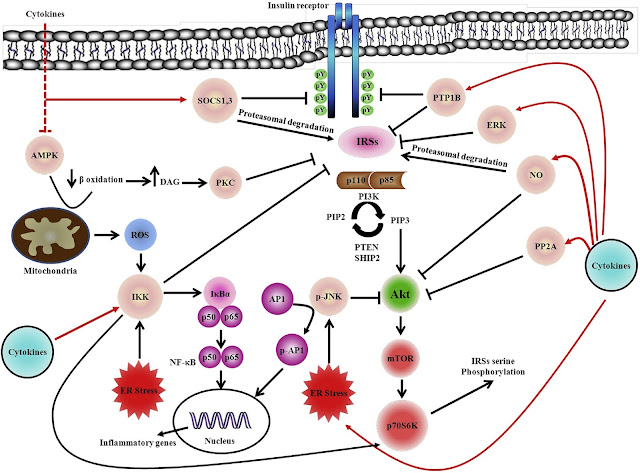
胰島素阻抗的分子機制。在分子水平上,已知受體信號傳導中的缺陷是靶組織中胰島素抵抗的主要原因。已報導在患有T2D的患者的肌肉和脂肪組織中胰島素受體的自動活化減少。此外,已經在肥胖和糖尿病受試者的骨骼肌中描述了磷酸肌醇(PI)3-激酶(PI3-激酶)和蛋白激酶B(PKB),也稱為Akt的表達降低。136 已經提出幾種機制參與肥胖和糖尿病患者的胰島素靶組織中,早期胰島素信號分子的表達降低和磷酸化減少。IRS蛋白的絲氨酸磷酸化可導致胰島素受體-IRS-1和IRS-1-PI3-激酶之間的解離,阻止PI3-激酶活化或IRS-1的加速降解。這種絲氨酸磷酸化繼而降低IRS-1酪氨酸磷酸化。已鑑定出許多絲氨酸激酶,例如磷酸化IRS-1上的絲氨酸殘基並削弱胰島素信號轉導的JNK和蛋白激酶C(PKC)。胰島素阻抗的另一個基本機制與抑制因子,例如細胞因子信號傳導抑制劑(SOCS)的誘導有關。最後,使胰島素中間體信號分子脫磷酸的磷酸酶的活性增加,可以抑制胰島素信號通路。在下面的部分中,我們將深入研究,上述信號途徑在將胰島素靶細胞中的炎症因子與胰島素阻抗相關聯中的作用(圖4)。
圖 4、胰島素靶組織中炎症誘導的胰島素阻抗的分子機制。來自循環來源或由組織駐留免疫細胞,局部產生的增加的細胞因子,可通過影響不同的中間體來抑制胰島素信號傳導。TNF-α可以誘導IKKb,SOCS1,SOCS3,PKC和ERK途徑的活性,導致胰島素靶組織中IRS的絲氨酸磷酸化。PTP1B是TNF-α的另一個靶,其過度激活導致胰島素受體和IRS的去磷酸化。TNF-α和IL-1β也被報導活化JNK,PP2A和iNOS信號傳導途徑。這些途徑的增加的活性導致Akt的失活,Akt是胰島素信號傳導途徑的重要中間體。TNF-α還通過TRAF2依賴性通路激活IKKb和JNK1,然後這些激活導致NF-kB和AP1的活化,NF-kB和AP1是刺激許多炎性細胞因子(包括TNF-α和IL-6)產生的轉錄因子。TNF-α還可通過激活SOCS1,SOCS3和NO產生來誘導IRS的蛋白酶體降解。最後,TNF-α通過抑制AMPK活性誘導胰島素阻抗。減少的AMPK活性抑制脂肪酸氧化,增加DAG積累,並通過激活PKC引起胰島素阻抗。
AMPK,AMP活化蛋白激酶; AP1,激活蛋白1; DAG,二醯基甘油; ER,內質網; ERK,細胞外信號調節激酶; IKKβ,IkB激酶β; IL,白介素; iNOS,誘導型一氧化氮合酶; IRS,胰島素受體受質; JNK,c-Jun N-末端激酶; mTOR,雷帕黴素的機制靶; NF-kB,核因子κB; NO,一氧化氮; PKC,蛋白激酶C; PP2A,蛋白磷酸酶2A; PTEN,磷酸酶和張力蛋白同源物; PTP1B,蛋白酪氨酸磷酸酶1B; ROS,活性氧; SHIP2,SH2結構域的肌醇-5-磷酸酶2; SOCS,細胞因子信號抑制因子; TNF,腫瘤壞死因子; TRAF,TNF受體相關因子。
哺乳動物雷帕黴素(rapamycin)靶標。一種細胞營養傳感器,哺乳動物雷帕黴素靶標(mTOR)整合了胰島素,氨基酸和營養信號通路。mTOR與2種不同的蛋白複合物(mTORC1和mTORC2)相關。mTORC2複合物對雷帕黴素不敏感,包括mTOR和rictor。該複合物參與Akt和其他激酶如蛋白激酶A,G和C的激活。mTORC1複合物對雷帕黴素敏感,包括銜接蛋白raptor。mTORC1是Akt和Akt誘導的磷酸化的下游,並且TSC1 / TSC2(結節性硬化複合物)的去穩定化是mTORC1激活所必需的。響應於胰島素和氨基酸,mTOR(其是絲氨酸/蘇氨酸激酶)磷酸化和調節p70S6激酶(S6K1激酶)和轉譯起始,真核轉譯起始因子4E結合蛋白的抑制劑的活性。在肥胖症和糖尿病中,mTORC1 / S6K信號被長期活化。細胞研究表明,這種慢性活化通過涉及絲氨酸磷酸化和IRS-1降解,以及IRS-1轉錄抑制的負反饋機制促進胰島素阻抗。與野生型同窩出生相反,缺乏S6K1激酶的轉基因小鼠,顯示出對年齡和飲食的強烈抗性誘導的肥胖症和胰島素阻抗。最近,mTORC1的過度活化與ER應激的發展有關,是JNK途徑的已知激活劑,提高了mTORC1 / S6K和JNK途徑,可能在肥胖症和糖尿病中合作以破壞胰島素作用的可能性。
還報導了炎症誘導的胰島素阻抗和mTORC1激活之間的關係。已經證明,TNF-α通過激活PI3-激酶-Akt-mTOR途徑,削弱了通過IRS-1的胰島素信號傳導。雷帕黴素(mTOR抑制劑)阻斷了TNF-α對IRS-1酪氨酸磷酸化的抑制。實際上,由TNF-α活化的IKKβ顯示直接磷酸化並抑制TSC1 / TSC2複合物,導致組成型mTOR活化。這種機制可通過S6K誘導的IRS-1絲氨酸磷酸化作用,促進TNF-α誘導的胰島素阻抗。在肝細胞中,IL-6激活mTOR途徑,導致SOCS3的上調。一種已知的胰島素信號傳導抑制劑,其降低胰島素受體-IRS-1相互作用並增加IRS-1降解。然而,mTOR在IRS-1絲氨酸磷酸化和胰島素阻抗中的功能作用可以在不同組織中變化,因為Ueno等人進行的研究顯示,慢性高胰島素血症 - mTOR對正常大鼠的激活劑具有雙重效應,刺激在WAT中的胰島素信號傳導,並在肝和肌肉中減少。
粒線體功能障礙(Mitochondrial dysfunction)。多年以來已知嚴重的粒線體功能障礙導致糖尿病。線粒體功能障礙和隨之而來的ROS產生的增加,反過來激活磷酸化IRS蛋白的各種絲氨酸激酶。此外,ROS通過激活在絲氨酸殘基磷酸化IRS-1的IKKβ來刺激促炎信號。儘管由ROS介導的絲氨酸激酶激活的詳細機制尚未清楚地了解,減少ROS產生的抗氧化劑或增加的解偶聯蛋白2/3的表達,改善粒線體功能和胰島素敏感性。在肥胖和T2D的狀態下,線粒體功能障礙導致FFA代謝物,如二醯基甘油(DAG)和長鏈脂肪醯基-CoA的積累。DAG的細胞內積累激活PKC,包括PKCβ,δ和θ,導致到IRS蛋白的絲氨酸磷酸化。實際上,PKCθ缺陷小鼠被保護免受脂肪誘導的胰島素阻抗。關於炎症在粒線體功能障礙中的作用,已經報導TNF-α治療導致粒線體膜電位降低和細胞內三磷酸腺苷的產生減少,以及顯著量的ROS的積累。在另一項研究中,在不同的細胞因子如TNF-α,IL-6和IL-1β中,只有TNF-α處理3T3 -L1細胞導致氧化應激增加,如通過超氧化物陰離子產生和蛋白質羰基化測量的。然而,特別是在骨骼肌和肝組織中的進一步研究,仍然需要確定粒線體功能障礙是炎症和T2D中的胰島素阻抗之間的聯繫。
ER應激。實驗證據表明ER應激在胰島素阻抗的誘導中具有重要作用。在胰島素阻抗調節中的兩個重要途徑,即NF-kB / IKKb和JNK / AP1,與IRE1和蛋白激酶RNA樣內質網激酶(PERK)的激活相關。ER應激誘導的JNK和IKKβ激酶的激活,通過絲氨酸磷酸化IRS-1抑制胰島素受體途徑參與肥胖和胰島素阻抗。事實上,ER應激參與肥胖和胰島素阻抗的飲食和遺傳模型。激活轉錄因子6和X-box結合蛋白1是ER功能的關鍵調節器及其適應性反應,因為X盒結合蛋白1的增益和離子功能研究證明了與體外和體內胰島素作用的緊密相互作用。儘管ER應激在胰島素阻抗的發病機制中的作用是眾所周知的,但是關於炎症細胞因子對胰島素靶組織中ER應激的直接作用的信息較少。然而,一項研究中的作者提供了TNF-α可以在鼠纖維肉瘤L929細胞中誘導ER應激的證據。在這項研究中,TNF-α以ROS依賴性方式誘導UPR。需要進一步的研究來闡明ER應激在炎症誘導的胰島素阻抗中的作用。
IkB激酶β。IKKβ是響應於炎症刺激的NF-κB活化的主調節物。IKKβ被胰島素阻抗的誘導劑,例如炎症細胞因子和FFA活化。據報導,在肥胖患者中IKKβ活性和表達增加。暴露於IL-1α或IL-1β的3T3-L1脂肪細胞,通過涉及通過骨髓分化初級應答基因88(MyD88)信號傳導途徑,激活JNK1和IKKβ的機制,顯示有缺陷的胰島素信號傳導和胰島素刺激的葡萄糖攝取。TNF-α通過TRAF2依賴性途徑瞬時激活IKKb和JNK1。
在各種胰島素靶細胞中,IKKβ活性的抑制防止了TNF-α或FFAs對胰島素信號轉導。在分子水平上,IKKb通過直接磷酸化促進IRS-1絲氨酸磷酸化,或通過其他激酶之間的串擾。在這方面,IKKb激活可以通過激活TSC1-TSC2-mTORC1-S6激酶1途徑,來促進IRS-1絲氨酸磷酸化。IKKβ促進胰島素阻抗的另一種機制是誘導不同細胞類型的促炎細胞因子產生。IKKβ可以激活NF-kB,NF-kB是一種刺激許多炎性細胞因子產生的轉錄因子,包括TNF-α和IL-6。因此,在IKKb和炎症介質之間存在正反饋迴路。
近年來,發現通過基於水楊酸鹽(salicylate-based)的抑制劑或降低的IKKβ表達,通過IKKβ途徑的信號傳導減少,通過影響局部或全身炎症在體內改善胰島素敏感性。在肝細胞中IKKb過度表達,導致局部和全身誘導促炎基因,和在不存在肥胖的情況下的全身胰島素阻抗。有趣的是,針對IL-6的中和抗體可以逆轉小鼠中IKKβ誘導的胰島素阻抗。
此外,在肝細胞中缺乏IKKb基因的小鼠,顯示降低了肝臟胰島素阻抗,以及減少的炎症細胞因子的表達,但是在響應於HFD的肌肉和脂肪中發展了胰島素阻抗。相反,骨髓樣細胞中IKKβ的破壞,導致在飲食誘導的胰島素模型中,胰島素敏感性的系統改善。這些研究結果表明,IKKβ在肝臟中局部起作用,並在骨髓細胞中全身起作用。根據這些數據,似乎IKKβ在肥胖誘導的胰島素阻抗中的作用的主要機制,取決於骨髓樣細胞的促炎細胞因子的產生,例如ATM。
C-Jun N-末端激酶1。在JNK的不同同種型中,JNK1也稱為應激激活蛋白激酶1,是環境脅迫和炎症的關鍵介質。發現在各種肥胖模型的肝臟,肌肉和脂肪組織中JNK活性增加。通過FFA,應激和炎症介質如TNF-α激活JNK,已經顯示增加IRS-1的絲氨酸磷酸化。在用TNF-α處理的肝細胞中胰島素阻抗的細胞模型中,報導了在Ser 307處增加的IRS-1磷酸化。更重要的是,在肥胖的JNK1敲除小鼠中沒有檢測到這種增加,表明IRS-1的Ser 307是體內JNK作用的靶標。此外,健康受試者的TNF-α輸注,增加了JNK1的磷酸化,伴隨增加的絲氨酸和減少IRS-1在骨骼肌細胞中的酪氨酸磷酸化。JNK1和IKKb被免疫傳感器如TLR的下游激活,並分別通過轉錄因子AP1和NF-kB參與炎性細胞因子的產生。許多產生的炎症細胞因子能夠激活這2種激酶,導致正向(feed-forward)放大迴路。在小鼠中的幾個體內研究已經證明,JNK途徑在胰島素阻抗的發展中的重要性。全身JNK1缺陷導致肥胖減少,增加胰島素敏感性,和在遺傳和飲食誘導的肥胖小鼠模型中,增強的胰島素受體信號傳導能力。當施用於糖尿病小鼠和飲食誘導的胰島素抗性小鼠時,一種細胞可滲透的JNK抑制肽(JNK-inhibitory peptide),改善葡萄糖耐量和胰島素敏感性。此外,肥胖糖尿病小鼠一種顯性陰性JNK1(dominant-negative JNK1)的肝特異性過度表達,顯著改善胰島素阻抗和顯著降低血糖水平;相反,野生型JNK1在正常小鼠肝臟中的表達,降低了胰島素敏感性。。此外,阻斷JNK活化挽救了由肝臟中FFA誘導的細胞和分子缺陷,導致內源性肝葡萄糖生成減少。總的來說,這些研究顯示JNK1是胰島素敏感組織中炎症與胰島素阻抗的關鍵介質。
細胞外信號調節激酶。ERK1 / 2(也稱為p44和p42)屬於MAPK家族。ERK1 / 2的活性在肥胖和糖尿病患者的脂肪,肝和肌肉組織中增加。已經報導,代謝和炎症應激可以增加肥胖症和T2D中幾種組織中ERK的活性。幾個細胞研究已經表明ERK1 / 2的激活導致IRS-1絲氨酸磷酸化。人類研究證實了這一事件,因為基礎ERK活性和IRS-1絲氨酸磷酸化,在來自患有T2D的患者的原發性肌細胞中異常增加。ERK通路還介導炎症細胞因子誘導的IRS-1表達的下調。在脂肪細胞中IL-1β激活ERK途徑誘導IRS-1 mRNA的轉錄減少,導致胰島素信號傳導活性和葡萄糖轉運的減少。ERK激活的炎症細胞因子也可以間接促進胰島素阻抗,通過刺激脂肪細胞脂解和釋放的FFA。ERK途徑在肥胖和胰島素阻抗的發展的貢獻,首次證明在ERK1缺陷小鼠。ERK1缺陷小鼠被保護免於飲食肥胖和胰島素阻抗,因為能量消耗增加。相反,缺乏信號轉導適配體p62(ERK抑制劑)的小鼠具有高基礎水平的ERK活性,並發展成熟發病的肥胖症和胰島素阻抗。另一項研究表明,ERK的抑制對胰島素阻抗具有有益效果,獨立於對體重增加的影響。
蛋白激酶C。PKC家族在許多細胞內信號傳導事件,包括細胞生長和分化中起重要作用。它由許多單個同種型組成,屬於3個不同類別,常規的(PKCs α,βI,βII和γ),新型(PKCs δ,ε,η和θ)和非典型(PKCs ζ和λ)基於它們結構上不同的N-末端調節結構域。最近的研究突出了PKCs作為一個多功能酶家族,發揮關鍵作用在各種組織中的胰島素阻抗中的作用。一些根據它們的激活刺激作用為胰島素信號傳導的介質(PKCζ,λ,β2,γ)或抑制劑(PKCζ,λ,α,θ,δ,ε和β1)。關於PKC在胰島素阻抗中的作用,據信PKC同種型是脂質誘導的胰島素阻抗的調節劑。炎症似乎不是胰島素阻抗狀態下PKC的直接調節劑。看起來從脂肪細胞分泌的細胞因子和免疫細胞,通過誘導FFA從脂肪組織釋放到循環中間接影響PKC。增加的循環中的FFA水平,然後導致外周組織中的脂質積累,導致不同PKC的活化。此外,已經報導TNF-α增加FFA酯化成DAG,最終導致增加的DAG含量增加。1DAG是PKC同種型β和θ的有效激活劑,其絲氨酸磷酸化IRS-1,導致骨骼肌細胞中的胰島素阻抗。然而,作者在一項研究中提示TNF-α對脂肪細胞中PKC的直接作用。該研究的結果表明,TNF-α對胰島素誘導的胰島素受體和IRS-1磷酸化,IRS-1 / PI3-激酶締合和葡萄糖轉運的抑制,部分地發生,通過調節PKC同種型α和δ的活性,以及它們與胰島素信號傳導級聯中的上游元件的締合。
如前所述,脂質是PKC的主要調節劑。現在已經清楚,PKCθ在肌肉中,和PKCε在肝臟中,繼DAG誘導的胰島素阻抗這些組織。類似地,PKCζ在介導神經醯胺在肌肉細胞和脂肪細胞中的有害作用的暗示,現在已經很好地建立。使用脂質輸注的研究,已經顯示血漿FFA水平的增加,導致肌肉和肝臟中細胞內脂肪醯基-CoA和DAG濃度增加,其隨後分別導致促炎症激酶PKCqθ和PKCε的激活。PKCζ的活化反過來導致增加的IRS-1絲氨酸磷酸化,其減少IRS-1酪氨酸磷酸化,並減少IRS-1相關的PI3-激酶活性,導致減少的胰島素刺激的葡萄糖轉運活性。使用相同的脂質輸注技術,還顯示PKCθ缺陷小鼠被保護免於脂肪誘導的胰島素信號傳導和葡萄糖運輸,在骨骼肌中的缺陷。
細胞因子信號抑制因子。SOCS蛋白家族也稱為Janus家族激酶結合蛋白或轉錄誘導Stat抑制劑的信號轉導和活化劑,包括8個成員(SOCS1-7和細胞因子誘導的STAT抑制劑)。它們在介導免疫細胞和代謝器官例如肝臟,脂肪組織和骨骼肌中的炎症反應中起重要作用。各種因素包括Janus激酶信號轉導物和轉錄激活物(JAK-STAT)途徑的活化劑,例如細胞因子和IFN-g的IL-6家族的成員,和非JAK-STAT活化細胞因子,例如TNF-α和生長因子,已被提議在不同組織中誘導SOCS蛋白。在肥胖症中,炎症導致肝,肌肉和脂肪組織中SOCS蛋白的上調。例如,SOCS1和SOCS3表達在肥胖囓齒動物的肝臟,脂肪組織和肌肉中增加。看來,通過細胞因子的SOCS表達的控制,是以組織特異性方式介導的,因為來自骨骼肌肌管的增加的IL-6產生,似乎是驅動肥胖人的骨骼肌中的SOCS3表達的主要因素,而在脂肪組織的囓齒類動物,TNF-α可能是最主要的因素。一些細胞研究表明SOCS蛋白負調節胰島素信號通路。已經提出了不同的機制來解釋SOCS蛋白如何抑制胰島素作用。例如,SOCS1抑制胰島素受體的催化活性。SOCS3通過其SH2結構域與胰島素受體上的近膜磷酸酪氨酸960直接結合,從而阻止IRS-1和IRS-2與受體的相互作用,從而抑制胰島素信號傳導。SOCS蛋白也針對蛋白酶體降解的IRS蛋白。SOCS1和SOCS3與酪氨酸磷酸化的IRS-1和IRS-2相互作用,導致其由蛋白酶體的泛素化和降解。體內研究也支持SOCS蛋白質在胰島素阻抗中的作用。在這方面,SOCS1或SOCS3在小鼠肝臟中的過表達減少IRS-1或IRS-2的表達,導致肝臟和全身胰島素阻抗。SOCS3在肌肉中的過度表達加重了飲食誘發的肥胖症和胰島素阻抗。此外,SOCS3在脂肪組織中或在肌肉保護的小鼠中針對肥胖症誘導的胰島素阻抗的靶向失效。SOCS7缺陷小鼠還顯示改善的葡萄糖耐量和胰島素敏感性。總之,上述發現表明SOCS蛋白參與胰島素敏感性的調節,並且它們的靶向可以是治療代謝疾病的治療靶標。
可誘導的一氧化氮合酶。一氧化氮(NO)是由NO合酶產生的內源性信號分子。NO作為多種生理過程如血管舒張的信號轉導分子。它還涉及許多病理生理狀態,包括胰島素阻抗。促炎細胞因子(TNF-α,IL-1和INF-γ)和內毒素通過增加大鼠骨骼肌,培養的肌細胞和脂肪細胞中誘導型一氧化氮合酶(iNOS)的表達協同增加NO產生。在胰島素信號傳導途徑中,NO可以通過引起特定半胱氨酸殘基的s-亞硝基化來降低Akt活性。增加的iNOS活性也導致培養的骨骼肌細胞中IRS-1的降解。此外,iNOS在肥胖的遺傳和飲食模型的肌肉和脂肪組織中增加。在這方面,iNOS缺陷小鼠具有改善的葡萄糖耐量,正常胰島素敏感性和骨骼肌中正常的胰島素刺激的葡萄糖攝取。最後,用iNOS抑制劑治療逆轉了ob / ob小鼠的空腹高血糖和高胰島素血症和改善的胰島素敏感性。iNOS抑制劑還增加IRS-1和IRS-2的蛋白表達,並增強ob / ob小鼠肝臟中IRS-1和IRS-2介導的胰島素信號傳導。因此,iNOS代表連接細胞分裂炎症與胰島素抵抗的另一種分子機制。
磷酸酶(Phosphatases)。肥胖中胰島素阻抗的另一種分子機制是增加胰島素敏感組織中幾種磷酸酶的表達和活性。磷酸酶是從細胞受質中去除磷酸鹽實體的酶。磷酸酶被分為不同類別,包括組氨酸磷酸酶,脂質磷酸酶,絲氨酸/蘇氨酸磷酸酶,蛋白質酪氨酸磷酸酶(PTP)和靶向磷酸-Tyr和磷酸-Ser / Thr殘基的雙特異性磷酸酶。在下一節中,我們討論在胰島素靶組織中,在炎症誘導的胰島素阻抗中起作用的磷酸酶。
蛋白酪氨酸磷酸酶。已經發現PTP通過催化酪氨酸脫磷酸化在穩態平衡中起重要作用。雖然幾種不同的磷酸酶被認為是胰島素作用的抑制劑,小鼠的體內分析強烈支持蛋白酪氨酸磷酸酶1B(PTP1B)作為胰島素信號的主要調節劑。PTP1B作為胰島素信號傳導的負調節劑,通過去磷酸化胰島素受體及其受質。肥胖,胰島素阻抗和糖尿病患者,在其肌肉和脂肪組織中顯示PTP1B的高表達。已報導PTP1B基因的啟動子和編碼序列內的遺傳變異與胰島素阻抗和T2D相關。此外,PTP1B在肌肉中的轉基因過度表達引起胰島素阻抗,損害胰島素信號傳導,並降低該組織中的葡萄糖攝取。相反,PTP1B缺陷小鼠對體重增加有抗性,表現出增加的胰島素敏感性,並且當經歷HFD時保持胰島素敏感。此外,使用小干擾RNA或反義寡核苷酸抑制PTP1B改善了db / db小鼠和體外的胰島素敏感性。已經提出各種因素如炎症,葡萄糖和棕櫚酸酯作為肥胖和糖尿病患者組織中PTP1B表達增加的原因。我們的實驗室提供證據棕櫚酸和炎症是促進骨骼肌細胞PTP1B表達的主要因素。棕櫚酸鹽和炎症可以通過涉及JNK和NF-kB途徑活化的機制加性誘導PTP1B的表達。在這方面,用TNF-α處理的棕色脂肪細胞顯示PTP1B mRNA,蛋白質和活性的顯著增強。還已經報導TNF-α在多種肥胖和糖尿病模型中的多種組織中通過NF-kB活化誘導PTP1B轉錄。因此,缺乏PTP1B表達賦予在體外或體內在骨骼肌中TNF-α誘導的胰島素抵抗的保護。總之,上述數據支持了通過調節PTP1B表達可以施加TNF-α對胰島素信號傳導的至少部分作用的想法。我們的數據還表明白細胞抗原相關(LAR),一種受體樣酪氨酸磷酸酶,可能是另一種介導炎症誘導胰島素阻抗的骨骼肌細胞。在我們的研究中,棕櫚酸酯誘導胰島素阻抗和LAR表達,而LAR抑制減弱C2C12細胞中棕櫚酸酯誘導的胰島素阻抗。
脂質磷酸酶。在從PI3激酶到Akt的信號轉導中,2種最好的已知負調節劑,磷酸酶和張力蛋白同源物(PTEN)和含SH2結構域的肌醇-5-磷酸酶2(SHIP2),通過分別在30和50位置磷酸化磷脂醯肌醇3,4,5-三磷酸(PIP3)來進行干擾。體外和體內研究提供了證據,表明SHIP2是胰島素信號通路的負調節劑之一。缺乏SHIP2基因的小鼠對胰島素的敏感性增加。關於SHIP2在炎症誘導的胰島素阻抗中的作用,更少的信息是可用的。然而,我們最近表明,SHIP2表達可以由棕櫚酸通過JNK和NF-kB依賴的機制誘導。鑑於FFA和細胞因子通過其的共同信號傳導途徑,可以建議SHIP2可能是骨骼肌細胞中炎症誘導的胰島素阻抗的介質。
絲氨酸/蘇氨酸磷酸酶。蛋白磷酸酶2A(PP2A)是一種普遍表達的細胞質絲氨酸 - 蘇氨酸磷酸酶,其在調節多種細胞蛋白質(包括代謝酶,激素受體,激酶級聯和細胞生長)中起重要作用。已經提出PP2A也參與胰島素的代謝作用。岡田酸(Okadaic acid),一種PP2A的抑制劑,可以激活葡萄糖轉運和GLUT4轉位。胰島素抑制對照大鼠中PP2A活性,並且在來自糖尿病大鼠的脂肪細胞中,胰島素作用對PP2A是被消除的。TNF-α誘導的胰島素阻抗伴隨著大鼠骨骼肌細胞中PP2A活性的增加。在這方面,來自具有T2D的胰島素阻抗患者的骨骼肌樣品中的PP2A活性增加。似乎PP2A直接去磷酸化和滅活Akt和PKC1,導致3T3-L1脂肪細胞中葡萄糖轉運刺激的減弱。
絲氨酸 - 蘇氨酸蛋白磷酸酶2C(PP2C)也參與炎症誘導的胰島素阻抗。AMP活化蛋白激酶(AMPK)在骨骼肌脂肪酸代謝的調節中具有重要作用。 AMPK活化通過磷酸化乙醯輔酶A羧化酶,導致骨骼肌脂肪酸氧化的速率增加,導致減少的丙二醯輔酶A,並且增加的長鏈脂肪醯輔酶A通量進入粒線體。肥胖症中脂肪酸氧化的降低速率與減少骨骼肌AMPK活性有關。關於TNF-α對胰島素信號傳導的影響,已經表明TNF-α通過PP2C的轉錄上調抑制AMPK活性。這反過來降低乙醯輔酶A羧化酶磷酸化,抑制脂肪酸氧化,增加肌肉內DAG積聚,並引起骨骼肌中的胰島素阻抗。
胰島(Islet)炎症。葡萄糖刺激的胰島素分泌是代謝燃料穩態的生理控制的中心,其損傷是胰腺β-細胞功能障礙的標誌。 β細胞功能障礙和死亡導致高血糖,從而導致糖尿病。胰腺β細胞以某種方式類似於免疫細胞,因為它們產生細胞因子;響應來自其他細胞和組織的細胞因子,響應免疫信號表達高水平的促炎蛋白例如NF-kB,iNOS,煙醯胺腺嘌呤二核苷酸磷酸氧化酶和TLR和其他蛋白。然而,不同於傳統的免疫炎症細胞,如巨噬細胞或嗜中性粒細胞,β細胞對免疫攻擊非常敏感,並且高度易受氧化應激的損害。
大量證據表明,局部和全身炎症在胰腺β-細胞功能障礙中具有關鍵作用。對糖尿病受試者和T2D患者的實驗研究顯示在診斷該疾病前幾年胰島炎症的存在。為了解釋糖尿病中β細胞衰竭的機制,已經解釋了幾種機制,包括ER應激,氧化應激,澱粉樣蛋白沉積,脂毒性和葡萄糖毒性。有趣的是,所有這些因素最終誘導炎症反應,而一些可能是由於炎症。低水平炎症反應可能促進β細胞修復和再生。但是慢性炎症反應與激活自身炎症過程可能會變得有害。因此,理解導致β細胞功能障礙和凋亡的炎症機制的改善,可能有助於開發用於預防或延緩糖尿病的新的治療策略。在這部分,我們打算審查胰腺β細胞功能障礙相對於T2D炎症的分子機制。
T2D中胰島免疫細胞的證據。為了支持T2D中的胰島炎,已經報導了患有T2D的患者的胰島中增加的免疫細胞數目,和增加的細胞因子和趨化因子水平。有趣的是,T2D的幾個動物模型顯示胰島免疫細胞浸潤。來自用HFD,db / db小鼠和Goto-Kakizaki大鼠飼養的T2D,C57BL / 6小鼠的患者的胰腺切片的分析顯示胰島內巨噬細胞數量增加。胰島駐留巨噬細胞和單核細胞群的分析顯示CD681巨噬細胞的顯著增加為約2.5%的T2D中的胰島。還已經報導,胰島中M1型巨噬細胞的減少恢復胰島素和胰腺和十二指腸同源盒1(PDX1)的表達並且改善胰島素分泌指數。此外,高濃度的葡萄糖或棕櫚酸酯增加從胰島產生趨化因子,這促進免疫細胞遷移和滲入胰島。增強的T2D患者胰島中的巨噬細胞和免疫細胞的數量解釋了它們的病理作用,以及胰島β細胞的最終不適當的功能。可能,巨噬細胞的早期浸潤可能有助於胰島功能和可塑性。然而,隨著疾病的進展,活化的巨噬細胞導致加速胰島細胞功能障礙和死亡。巨噬細胞的存在也可能是吞噬死亡胰島組織的β細胞死亡的結果。
如前所述,巨噬細胞和免疫細胞在不同的組織和器官中發揮不同的作用和表型。通過流式細胞術在胰島中巨噬細胞活化的極性分析顯示了胰島中的2種主要類型的巨噬細胞:CD11b+Ly-6C+單核細胞/巨噬細胞和CD11b+Ly-6C-巨噬細胞。在正常條件下和健康小鼠中,CD11b+Ly-6C-細胞顯示M2型表型,而在T2D模型中,CD11b+Ly-6C+單核細胞/巨噬細胞是M1型表型。因此,巨噬細胞極性似乎向T2D胰島中的M1移動。因此,胰島中免疫細胞的存在和功能性參與提示強烈的炎症證據是胰島功能障礙的負責因素。
肥胖和T2D中胰島免疫系統的激活。胰島中炎症過程的最早證據起因於高血糖誘導β細胞凋亡的觀察結果。通過檢查基礎機制,顯示高葡萄糖濃度誘導促細胞凋亡受體FAS(也稱為CD95)在β細胞上的表達,其由β細胞產生的IL-1β進一步上調。因此,IL-1β和FAS有助於葡萄糖誘導的β細胞分泌功能的損傷和凋亡。進一步在體外實驗表明,暴露分離的人胰島高水平葡萄糖增加IL-1β,這隨後的NF-κB活化,FAS上調,DNA片段化,並減少胰島素分泌的分泌。已經提出了諸如營養供應(葡萄糖和FFA),胰島澱粉樣蛋白多肽(IAPP),IL-1β自體刺激,IL-1RA減少和胰島源性趨化因子等幾個因素作為IL-1β從胰島產生的觸發因素。在本節中,我們描述胰島IL-1β生產的原因。圖4示出了參與β細胞中IL-1b產生的信號傳導途徑。
營養過剩。營養誘導的IL-1β活化的基本機制是複雜的。來自營養過剩的循環FFA的水平的增加,被認為有助於與T2D相關的進行性β細胞衰竭。棕櫚酸通過激活TLR4信號傳導將單核細胞/巨噬細胞吸引到胰島。為了證實這一假設,將棕櫚酸乙酯輸注到小鼠中減少了胰腺功能基因如PDX1,胰島素和胰島素2(Ins2)的表達。有趣的是,在缺乏TLR4的小鼠和其銜接蛋白MyD88中輸入棕櫚酸乙酯對胰腺功能基因的表達沒有影響。進一步的流式細胞術分析表明,只有在TLR4和MyD88的存在,CD11b+Ly-6C+ M1型促炎單核細胞/巨噬細胞積累在胰島響應棕櫚酸,這表明TLR4信號參與巨噬細胞浸潤胰島。進一步的實驗證明棕櫚酸通過小鼠胰島瘤6和分離的胰島β細胞中的TLR4-MyD88信號傳導誘導趨化因子(C-C基序)配體2(CCL2)和CXC趨化因子配體1(CXCL1)的分泌。招募的巨噬細胞到胰島然後分泌IL-1β和TNF-α響應棕櫚酸鹽影響β細胞功能。體內研究支持這些事件,因為使用氯酸鹽填充的脂質體的巨噬細胞的消耗防止響應棕櫚酸鹽的胰島內CD11b+Ly-6C+細胞的積累,並抑制PDX1,胰島素和Ins2的下調,以及胰島中IL-1β和TNF-α的上調。
葡萄糖。胰腺β細胞非常容易受到由高血糖引起的損傷。慢性暴露於異常高的血糖對胰島素合成,分泌和細胞存活具有有害影響。幾種機制,包括減少胰島素基因表達,增加ER應力,增強慢性氧化應激,線粒體功能障礙和增加炎症反應可以解釋慢性高葡萄糖濃度對β細胞功能的有害影響。大量證據現在顯示,慢性高血糖誘導胰島中的非免疫介導的炎症途徑(例如,IL-1β,NF-kB和FAS受體)。葡萄糖通過激活NLRP3途徑刺激IL-1β產生(圖5)。高血糖引起硫氧還蛋白相互作用蛋白從硫氧還蛋白在ROS的影響下的解離,允許硫氧還蛋白相互作用蛋白與NLRP3炎症小體的結合。這導致胱天蛋白酶1的活化和前IL-1b的後續加工和成熟IL-1β的釋放。
胰島澱粉樣蛋白多肽(IAPP)。在T2D中,胰島中發生澱粉樣蛋白的積累。有關IAPP是否負責功能性β細胞質量的下降,或僅僅是β細胞死亡的標誌物,仍在進行爭論。IAPP也稱為胰島澱粉樣多肽,在胰島中發現的特異性多肽,由37個氨基酸組成並且通過β細胞與胰島素共分泌。以前的研究表明,過度表達人類IAPP的小鼠激活JNK途徑,導致β細胞的凋亡。還報導了IAPP聚集體可以通過誘導炎症反應,積極地促進T2D中的胰島功能障礙。IAPP的聚集體激活骨髓來源的樹突狀細胞中的炎症小體,導致IL-1β以MyD88依賴性方式產生。此外,β細胞通過產生趨化因子CCL2直接響應IAPP聚集體,然後趨化因子CCL2吸引巨噬細胞到胰島。表達移植到糖尿病小鼠中的人IAPP的小島快速發展胰島中的澱粉樣蛋白沉積,以及巨噬細胞積累。此外,IL-1β拮抗劑可以減少小鼠中的澱粉樣蛋白沉積,巨噬細胞募集和最終的高血糖。
IL-1β自體刺激。初始IL-1β誘導可以通過自身炎症循環擴增。事實上,人類胰島,特別是純化的人β細胞,對IL-1β自體刺激非常敏感。這可能是IL-1R1在這些細胞上豐富表達的結果。許多組織中IL-1R1表達的分析顯示,與其它小鼠組織相比,在小鼠胰島和由胰島素生成細胞系MIN6中表達最高水平。IL-1β自體刺激胰島可以通過減少NF-kB活性或阻斷IL-1R1信號來預防。
IL-1受體拮抗劑。IL-1RA在非糖尿病個體的內分泌胰腺中高表達,但在患有T2D的患者的胰島中降低,這提高了β細胞對IL-1β的易感性。負責這種減少的確切機制仍有待闡明,但脂肪組織衍生激素瘦素可能涉及,因為它減少人類胰島在體外的IL-1RA表達。
胰島衍生趨化因子。胰島細胞在T2D的背景下產生廣泛的趨化因子。用高濃度的葡萄糖和棕櫚酸的胰島的體外處理增加幾種生物活性趨化因子的產生,例如人胰島中的CXCL8和CCL3和小鼠胰島中的CXCL1。從T2D(Goto-Kakizaki大鼠,HFD小鼠和Zucker大鼠)的囓齒動物模型分離的胰島也顯示包括CXCL1,CCL2和CCL3的各種趨化因子的產生增加。重要的是,這些研究結果對人類的相關性支持在激光捕獲幾乎純的β細胞 T2D患者上調的各種趨化因子的證據。雖然大多數趨化因子由胰島中的β細胞產生,但一些(例如,CXCL8)也可由胰腺α細胞產生。各種趨化因子的精確功能仍有待澄清; 然而,它們在T2D中的免疫細胞的組織浸潤中具有關鍵作用。
IL-1β誘導胰腺β-細胞功能障礙的分子機制。在分子水平,IL-1β誘導的胰腺β-細胞功能障礙是通過不同的中間體介導的。用IL-1β慢性處理胰腺β細胞刺激iNOS的表達,導致產生大量的NO,這影響電子轉移,減少線粒體中的ATP合成,並增強促炎基因的表達。低水平的細胞ATP含量最終導致胰島素分泌的減少。已經顯示NF-kB主要介導IL-1β或其他細胞因子誘導的胰腺β細胞中iNOS的活化。長時間激活NF-kB誘導包括胰島素,GLUT2和PDX-1的β細胞特異性蛋白質的達的持續降低,伴隨iNOS表達的增加。錳超氧化物歧化酶的過度表達與NF-kB活化和iNOS表達的減少,很大程度上表現出對IL-1β誘導的β細胞凋亡的保護作用。對NF-kB(p50)缺陷小鼠的體內研究也顯示對多種低劑量鏈脲黴素誘導的糖尿病的抗性。
ER應激是IL-1β介導的胰腺β-細胞凋亡和死亡的另一種機制。為了證實這一假設,用4-苯基丁酸(4-phenyl butyric acid)預處理β細胞以減輕ER應激,顯著降低IL-1β誘導的細胞凋亡。IL-1β和IFN-γ組合通過刺激NO合成,顯著減少肌漿網膜泵Ca2+ ATP酶2b蛋白表達,和耗盡ER Ca2+存儲,隨後激活ER應激通路。IL-1β加IFN-γ也增加死亡蛋白5的表達,其誘導ER應激並因此觸發β細胞凋亡。
圖 5、胰島炎症的基礎分子機制。循環FFA如棕櫚酸的水平增加通過激活TLR4信號傳導將單核細胞/巨噬細胞吸引到胰島。招募的巨噬細胞到胰島然後分泌IL-1b和TNF-α響應棕櫚酸鹽影響β細胞功能。此外,FFAs可以通過NF-kB依賴性機制誘導β細胞中的前IL-1β表達。慢性高血糖還在胰島中誘導非免疫介導的炎症途徑(例如IL-1β,NF-kB和FAS受體)。葡萄糖通過參與NLRP3途徑刺激IL-1β產生。高血糖通過ROS和ER應激機制活化NLRP3炎症小體,導致胱天蛋白酶1的活化和前IL-1β的後續加工和成熟IL-1β的釋放。分泌的IL-1βs然後在巨噬細胞和β細胞中產生炎症的循環。這些事件最終可以通過包括ER應激和NO產生的不同機制誘導胰腺β-細胞功能障礙。 ER,內質網; FFA,游離脂肪酸; IL,白介素; IL-1RI,IL-1I型受體; NF-kB,核因子κB; NLR,NOD樣受體; NLRP3,含有3的NLR pyrin結構域; ROS,活性氧; TLR,toll樣受體; TNF,腫瘤壞死因子。
十二、β細胞和胰島素敏感性組織之間的串聯
本綜述的最後一節討論了T2D發病機制中β細胞和胰島素敏感組織之間的串擾。胰島素阻抗和β細胞功能障礙在T2D發病機制中的相對重要性已經被討論了很長時間。許多團體建議胰島素阻抗是主要異常,而其他人認為降低的β細胞功能是T2D發病機理的先決條件。主要基於白種人受試者,已經提出T2D由胰島素阻抗觸發,胰島素阻抗最初通過增加的β細胞應答而補償。這種情況最終導致T2D,因為胰腺β細胞的耗盡。另一方面,已報導減少的β-細胞功能已經存在於具有增加的糖尿病風險的不同組中,包括糖尿病患者的一級親屬,妊娠糖尿病或多囊卵巢綜合徵的婦女和老年個體。此外,東亞人的T2D主要表現為β細胞功能障礙。胰島素抗性通常在高加索人中較高,而β-細胞應答在東亞人中較低。因此,這些研究表明不同人群中T2D病理生理學的深刻差異。
胰島素阻抗和β細胞功能障礙之間的關係是動態的,並且主要取決於主要由血糖和胰島素狀態確定的代謝狀態。在生理條件下,通過涉及胰島β細胞和胰島素敏感組織的反饋迴路來測定葡萄糖代謝。響應於β細胞刺激釋放的胰島素介導胰島素敏感組織對葡萄糖,氨基酸和FFA的攝取。反過來,這些組織向胰島反饋關於胰島素的需要的信息。隨著胰島素阻抗進展和葡萄糖攝取受損,血漿葡萄糖濃度的升高變得過大,但是β細胞胰島素分泌的增加足以將空腹血漿葡萄糖濃度維持在正常範圍內。個體能夠增加胰島素分泌的程度決定他們是否患有糖尿病。這反過來又受其遺傳背景的影響,這解釋了為什麼一些肥胖和胰島素抗性受試者不發展T2D。然而,最終胰島素阻抗變得如此嚴重,使得補償性高胰島素血症不再足以將空腹葡萄糖濃度維持在正常範圍內。高血糖的發展進一步刺激胰島素的β-細胞分泌,並且所得的高胰島素血症引起胰島素受體的下調,導致胰島素敏感組織中的胰島素阻抗加劇。伴有持續性高血糖,增加的飽和FFA誘導對β細胞有害的葡萄醣脂毒性狀態和炎症反應。這些條件降低胰島素合成和分泌,從而損害β細胞結構和功能。總之,T2D的演變需要在胰島素分泌和胰島素作用中存在缺陷,並且這兩種缺陷都可以具有遺傳和獲得的成分。現在清楚的是,在任何給定的糖尿病患者中,無論什麼缺陷(胰島素阻抗或受損的胰島素分泌)引發葡萄糖代謝中的干擾,其最終將伴隨著其對應物的出現。
十三、結論
基於本綜述中總結的證據,我們強調了逐步進展為肥胖狀態下胰島素阻抗和β細胞功能障礙的過程。在肥胖中,脂肪組織塊的擴張導致系統性FFA通量,微量缺氧,ER應激和最終的脂肪組織炎症增加。在脂肪組織炎症中,巨噬細胞和其它免疫細胞的活化導致多種趨化因子(其招募另外的巨噬細胞)和促炎細胞因子的釋放。反過來,這些細胞因子啟動引起胰島素靶細胞(例如脂肪細胞和肝細胞)內的炎症通路的活化的過程,導致這些細胞中的胰島素阻抗。在分子水平上,已經提出幾種機制參與炎症誘導的胰島素阻抗。這些機制包括JNK,IKKβ,PTP1B,SOCS,iNOS,PP2A,PP2C和氧化應激通路的活化的增加。除了脂肪,肝臟和骨骼肌組織內的炎症誘導的胰島素阻抗之外,相同的過程最可能發生在胰腺中。胰腺還含有組織駐留巨噬細胞池。這些免疫細胞在高葡萄糖和FFA的情況下產生最終誘導胰腺β細胞凋亡的炎症反應。因此,靶向炎症和更具體地組織特異性巨噬細胞,其募集和激活的策略可能是治療和預防肥胖相關代謝性疾病的有希望的選擇是合理的。然而,應當注意,肥胖誘導的炎症領域是相對新的,並且我們需要來自肥胖症和T2D受試者的長期隨訪研究的更多數據以說明抗炎劑在治療T2D中的益處。





沒有留言:
張貼留言