許多婦女常因家事或工作感到腰痠背痛、全身不適,但經醫院檢查(驗血、X光)卻顯示正常,因此常被誤解為「公主病」。醫師提醒,這可能是纖維肌痛症(Fibromyalgia)。纖維肌痛症的原因不明,主要症狀包括慢性疼痛、疲勞和失眠,需要對症下藥才能解決問題。
圖1. 纖維肌痛症(FM) : 一種放大的疼痛反應 (資料來自: 參考文獻1)
1. 疼痛反應的放大 (圖1)
纖維肌痛症患者的疼痛反應會被異常放大。正常情況下,神經系統對刺激的反應是線性的,即使強烈刺激也不會引起過度疼痛。然而,外傷可能導致疼痛反應曲線向左移動,使得:
痛覺過敏 (Hyperalgesia):較輕微的疼痛刺激卻會感覺非常明顯的疼痛。
異常性疼痛 (Allodynia):通常無痛的刺激(如輕輕觸摸)也會引起疼痛。
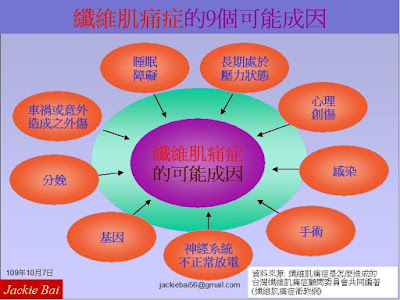
圖2. 纖維肌痛症的9個可能成因 (資料來自: 參考文獻2)
2. 纖維肌痛症的可能成因 (圖2)
纖維肌痛症的發生可能與多種因素有關:
神經傳導物質失衡:導致神經系統過度放電,使痛覺被異常放大。
家族遺傳:遺傳因素可能增加患病風險。
睡眠障礙:長期的睡眠問題會加劇症狀。
身體與心理壓力:慢性壓力是重要的誘發和加重因素。
圖3. 痠痛是怎麼一回事?酸的致痛與止痛訊息 (資料來自: 參考文獻3)
3. 肌肉酸化與疼痛機制 (圖3)
肌肉酸化在疼痛中扮演關鍵角色:
當肌肉酸化時,酸會激活具有 ASIC3 或 TRPV1 的痛覺神經,導致疼痛過敏化和神經可塑性變化。
同時,酸也會激活具有「酸止痛」能力的神經釋放物質 P,以抑制疼痛。
神經可塑性改變:包括神經營養因子(如 BDNF)水準降低、樹突萎縮、神經發生和突觸形成減少,以及神經膠質細胞功能障礙。這些改變進一步導致神經化學失衡。
圖4. 骨骼肌間質pH降低和細胞葡萄糖代謝受損 (資料來自: 參考文獻4)
4. 骨骼肌間質pH降低與細胞葡萄糖代謝受損 (圖4)
骨骼肌間質 pH 降低與葡萄糖代謝異常密切相關:
過多的葡萄糖/肝糖利用率和有氧代謝障礙會導致通過糖酵解途徑產生乳酸。
組織液中 pH 降低會降低胰島素與其受體的結合親和力,進而抑制經由葡萄糖轉運蛋白 4 (GLUT4) 的胰島素信號傳導活性和葡萄糖攝取。
因此,低的組織液 pH 值會降低骨骼肌細胞中胰島素對其受體的親和力,導致胰島素阻抗和高血糖症。
圖5. 中樞神經系統神經遞質影響疼痛 (資料來自: 參考文獻5)
5. 中樞神經系統神經遞質對疼痛的影響 (圖5)
中樞神經系統的神經遞質在疼痛傳遞中扮演重要角色:
促進疼痛的神經遞質:如物質 P、麩胺酸、神經胜肽 Y、皮質醇釋放因子、腦啡肽酶、細胞激素等,在纖維肌痛症患者體內水準可能升高。
抑制疼痛的神經遞質:如血清素、正腎上腺素、多巴胺、GABA、內源性鴉片類物質等,在纖維肌痛症患者體內水準可能降低。
某些藥物(如普瑞巴林、度洛西汀、米那普崙)已被證明對纖維肌痛症有效,可能部分通過調節這些神經遞質起作用。
6. 反覆和間歇性噪音壓力 (RISS) 誘導的慢性痛覺敏化機制 (圖6)
研究證實長期壓力會造成身體慢性疼痛:
RISS 會引起過度的氧化應激和脂質氧化,導致通過血小板活化因子乙醯水解酶 (PAF-AH) 催化或 ox-PCs 自發脫醯,產生溶血磷脂醯膽鹼 (LPC) 16:0。
LPC16:0 通過激活肌肉組織中的酸敏感離子通道 3 (ASIC3) 引起傷害性反應,並導致慢性痛覺過敏。
通過減少 LPC 生成,PAF-AH 抑制劑可能因此在與壓力有關的疼痛疾病(如纖維肌痛症)中有益。
 圖7. 睡眠三原力相互作用 (資料來自: 參考文獻7)
圖7. 睡眠三原力相互作用 (資料來自: 參考文獻7)7. 生活習慣的重要性與睡眠三原力 (圖7)
生活習慣對健康至關重要,代謝症候群即是生活習慣病,可通過以下方式改善:
均衡飲食
規律運動
改善生活習慣 隨著時代演變,生活習慣的改變使得以往在中老年人身上出現的疾病也開始在年輕人身上出現。
晝夜節律、睡眠與壓力:三者息息相關。晝夜節律被打亂與長期的負面健康結果相關,包括肥胖。
參考文獻
Gottschalk A and Smith DS. 2001; Am Fam Physician. 63:1979-1986.
纖維肌痛症是怎麼造成的。台灣纖維肌痛症顧問委員會共同編著(纖維肌痛症衛教網) https://www.pfizer.com.tw/mediacalinfo/2010/27/page03.html
陳志成。【專欄】痠痛是怎麼一回事?。漫步科研, 生命科學, 科普專欄。中研院訊網頁(2018年9月27日) https://newsletter.sinica.edu.tw/%E7%97%A0%E7%97%9B%E6%98%AF%E6%80%8E%E9%BA%BC%E4%B8%80%E5%9B%9E%E4%BA%8B%EF%BC%9F/ https://jbiomedsci.biomedcentral.com/articles/10.1186/s12929-018-0486-5
Aoi, W., Zou, X., Xiao, J., & Marunaka, Y. (2019). Body Fluid pH Balance in Metabolic Health and Possible Benefits of Dietary Alkaline Foods. https://www.atlantis-press.com/journals/efood/125918568/view
Harte, Steven E.; Harris, Richard E.; Clauw, Daniel J. (2018). "The neurobiology of central sensitization." Journal of Applied Biobehavioral Research 23(2): n/a-n/a.
Hung CH, Lee CH, Tsai MH, Chen CH, Lin HF, Hsu CY, Lai CL, Chen CC. Activation of acid-sensing ion channel 3 by lysophosphatidylcholine 16:0 mediates psychological stress-induced fibromyalgia-like pain. Ann Rheum Dis. 2020 Sep 9:annrheumdis-2020-218329. doi: 10.1136/annrheumdis-2020-218329. Epub ahead of print. PMID: 32907805.
吳奇霖。失眠與睡眠 – 我們為什麼會想睡覺?2018年5月5日。 https://www.careonline.com.tw/2018/05/sleep.html?fbclid=IwAR0Y9fbJsfLuwSMxi6prGgrwdbTUUJDrGeZo8FtFviuqr_O1Hk_ZKYk6wl8